1. Pierwiastki składają się z niezmiernie małych, niepodzielnych cząstek (atomów), które zachowują swoją indywidualność podczas przemian fizycznych i chemicznych.
2. Wszystkie atomy jednego pierwiastka są jednakowe i mają ten sam ciężar. Od atomów innych pierwiastków różnią się ciężarem i właściwościami.
3. Chemiczne łączenie się pierwiastków jest łączeniem się poszczególnych atomów.
Z drugiego i trzeciego założenia teorii atomistycznej od razu wynika prawo stosunków stałych, mówiące, że każdy związek chemiczny ma stały skład ilościowy (Proust, 1799). Jeżeli bowiem dwa atomy A i B o masach mA i mB tworzą cząsteczkę AB, to stosunek mas w tym związku mA/mB=const. Rozpatrująć w analogiczny sposób tworzenie się z dwóch pierwiastków kilku związków, np. N2O, NO, N2O3, NO2, N2O5, otrzymamy prawo stosunków wielokrotnych Daltona. Prawo to mówi, że jeżeli dwa pierwiastki łącząc się z sobą tworzą dwa lub więcej związków chemicznych, to ilości wagowe jednego pierwiastka przypadające na stałą ilość wagową drugiego pierwiastka pozostają do siebie w stosunku prostych liczb całkowitych.
Prawo stosunków wielokrotnych Daltona wskazuje na prostą zależność liczbową dwóch określonych pierwiastków tworzących kilka związków chemicznych.
Prawo stosunków objętościowych Gay- Lussaca (1808) wskazuje na prostą zależność liczbową objętości łączących się różnych gazów. Ta druga zależność jest tak prosta i powszechna, że od razu nasuwa się wniosek, iż musi istnieć związek między liczbami reagujących cząstek (,,atomów" Daltona) a zajmowaną przez nie objętością. Jednak Gay- Lussac nie wyciągnął tak zdawałoby się oczywustego wniosku, że w tej samej temperaturze i pod tym samym ciśnieniem jednakowe objętości różnych gazów (lub ich proste wielokrotności) muszą zawierać jednakową liczbę reagujących cząsteczek. Tę daleko idącą konsekwencję prawa stosunków objętościowych zauważył jednak natychmiast, ku swemu wielkiemu niezadowoleniu, Dalton. Dalton od razu zorientował się, że prawo Gay- Lussaca jest sprzeczne z teorią atomistyczną. Dalton ,,twórca" atomów, rozumował wg Gay Lussaca:
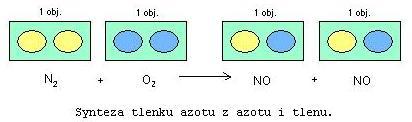
1 objętość azotu + 1 objętość tleny daje dwie objętości NO
zatem
N atomów azotu + N atomów tleny daje 2N cząsteczek NO
i
1 atom azotu + 1 atom tlenu daje 2 cząsteczki NO
a więc
1/2 atomu azotu + 1/2 atomu tlenu daje 1 cząsteczkę NO
Zakładając niepodzielność atomów, Dalton odrzucił i stanowczo krytykował doświadczenia Gay- Lussaca. Po trzyletnim sporze obu badaczy pogodził w 1811 r. Avogadro, wskazując, że wystarczy przyjąć, iż cząsteczki gazowe są dwuatomowe, by uniknąć wszelkich trudności.
Dobrym przykładem wskazującym na reakcję pomiędzy cząsteczkami jest synteza wody z H2 i O2. W przypadku reakcji:
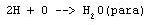
po spaleniu mieszaniny w eudiometrze para powinna stanowić 1/3 objętości pozątkowej mieszaniny. W reakcji:
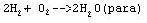
objętość pary powinna wynosić 2/3 objętości początkowej. Wynik doświadczenia potwierdza reakcję (2).
W ten sposób ostatecznie Avogadro stał się autorem doniosłej hipotezy, nazwanej hipotezą Avogadra, że równe objętości gazów w tych samych warunkach ciśnienia i temperatury zawierają jednakową liczbę cząsteczek. Niemniej pomieszanie obu pojęć: atomu i cząsteczki, trwało jeszcze długi czas i dopiero Cannizzaro w 1858 r. utwierdził hipotezę Avogadra i otworzył jednolitą skalę mas atomowych i cząsteczkowych.
Źródło: Koluszek
