Έκθεση Αξιολόγησης της Διεθνούς Ομάδας των Κορυφαίων Επιστημόνων
Δείτε την Έκθεση Αξιολόγησης εδώ : https://cormandrostenreview.com/report/
Έκθεση αξιολόγησης της εργασίας Corman-Drosten et al. Eurosurveillance 2020
27 Νοεμβρίου 2020
Αυτή η εκτενής έκθεση αξιολόγησης έχει υποβληθεί επίσημα στο συντακτικό συμβούλιο της Eurosurveillance στις 27 Νοεμβρίου 2020 μέσω της πύλης υποβολής τους, που επισυνάπτεται σε αυτήν την έκθεση αξιολόγησης είναι μια επιστολή αιτήματος ανάκλησης , υπογεγραμμένη από όλους τους κύριους & συν-συγγραφείς. Τα πρώτα και τα τελευταία ονόματα είναι ο πρώτος και ο δεύτερος κύριος συγγραφέας. Όλα τα ονόματα μεταξύ τους είναι συν-συγγραφείς.
Εξωτερική αξιολόγηση από ομοτίμους του τεστ RT-PCR για την ανίχνευση του SARS-CoV-2 διαπιστώνει 10 σημαντικά επιστημονικά σφάλματα σε μοριακό και μεθοδολογικό επίπεδο: συνέπειες για ψευδώς θετικά αποτελέσματα.
Pieter Borger (1) , Bobby Rajesh Malhotra (2) , Michael Yeadon (3) , Clare Craig (4) , Kevin McKernan (5) , Klaus Steger (6) , Paul McSheehy (7) , Lidiya Angelova (8) , Fabio Franchi (9) , Thomas Binder (10) , Henrik Ullrich (11) , Makoto Ohashi (12) , Stefano Scoglio (13) , Marjolein Doesburg-van Kleffens (14) , Dorothea Gilbert (15) , Rainer Klement (16) , Ruth Schruefer (17) , Berber W. Pieksma (18), Jan Bonte (19) , Bruno H. Dalle Carbonare (20) , Kevin P. Corbett (21) , Ulrike Kämmerer (22)
ΣΥΝΟΨΗ
Στη δημοσίευση με τίτλο «Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR» (Eurosurveillance 25 (8) 2020) οι συγγραφείς παρουσιάζουν μια διαγνωστική ροή εργασίας και ένα πρωτόκολλο με τη μέθοδο RT-qPCR για την ανίχνευση και τη διάγνωση του 2019-nCoV (τώρα γνωστού ως SARS-CoV-2), το οποίο ισχυρίζονται ότι έχει, καθώς επίσης ότι συνιστά μια ισχυρή διαγνωστική μεθοδολογία για χρήση σε εργαστήρια δημόσιας υγείας.
Υπό το πρίσμα όλων των συνεπειών που προκύπτουν από αυτήν την ίδια δημοσίευση για τις κοινωνίες σε όλο τον κόσμο, μια ομάδα ανεξάρτητων ερευνητών πραγματοποίησε μια αναλυτική επισκόπηση της προαναφερθείσας δημοσίευσης στην οποία:
- όλα τα στοιχεία του παρουσιαζόμενου σχεδιασμού δοκιμής διασταυρώθηκαν
- οι συστάσεις του RT-qPCR πρωτοκόλλου αξιολογήθηκαν στη βάση των διεθνώς αποδεκτών εργαστηριακών πρακτικών και
- οι παράμετροι εξετάστηκαν συγκρινόμενοι με τη σχετική επιστημονική βιβλιογραφία που καλύπτει το πεδίο.
Το δημοσιευμένο πρωτόκολλο RT-qPCR για την ανίχνευση και τη διάγνωση του 2019-nCoV και το χειρόγραφο υποφέρουν από πλήθος τεχνικών και επιστημονικών σφαλμάτων, όπως ανεπαρκής σχεδιασμός των εκκινητών (primers), προβληματικό και ανεπαρκές πρωτόκολλο RT-qPCR και απουσία ακριβούς δοκιμής επικύρωσης. Ούτε το τεστ που παρουσιάστηκε ούτε το ίδιο το χειρόγραφο πληρούν τις προϋποθέσεις για μια αποδεκτή επιστημονική έκδοση. Επιπλέον, δεν αναφέρονται σοβαρές συγκρούσεις συμφερόντων (conflicts of interest) των συγγραφέων. Τέλος, το πολύ σύντομο χρονικό διάστημα που διαμεσολάβησε μεταξύ της υποβολής και της αποδοχής της δημοσίευσης (24 ώρες) σημαίνει ότι μια συστηματική διαδικασία αξιολόγησης από ομότιμους (peer review) είτε δεν πραγματοποιήθηκε εδώ, είτε εάν πραγματοποιήθηκε ήταν προβληματικά κακής ποιότητας. Με τη παρούσα, παρέχουμε αδιάσειστα αποδεικτικά στοιχεία για αρκετές επιστημονικές ανεπάρκειες, λάθη και ελαττώματα.
Λαμβάνοντας υπόψη τα επιστημονικά και μεθοδολογικά ελαττώματα που παρουσιάζονται εδώ, είμαστε βέβαιοι ότι το συντακτικό συμβούλιο της Eurosurveillance δεν έχει άλλη επιλογή από το να ανακαλέσει τη δημοσίευση.
ΣΥΝΟΠΤΙΚΗ ΕΚΘΕΣΗ ΑΞΙΟΛΟΓΗΣΗΣ
Η παρούσα έκθεση εντοπίζει και αναδεικνύει σοβαρά ελαττώματα της εργασίας Corman-Drosten, η σημασία των οποίων οδήγησε σε παγκόσμια εσφαλμένη διάγνωση λοιμώξεων που αποδίδονται στο SARS-CoV-2 και σχετίζονται με τη νόσο COVID-19. Βρισκόμαστε αντιμέτωποι με αυστηρούς αποκλεισμούς που έχουν καταστρέψει τη ζωή και βιός πολλών ανθρώπων, την περιορισμένη πρόσβαση στην εκπαίδευση και αυτοί οι επιβαλλόμενοι περιορισμοί από κυβερνήσεις σε όλο τον κόσμο συνιστούν μια άμεση επίθεση στα βασικά δικαιώματα των ανθρώπων και τις προσωπικές τους ελευθερίες, με αποτέλεσμα την παράπλευρη ζημία για ολόκληρες οικονομίες σε παγκόσμια κλίμακα.
Η εργασία των Corman-Drosten πάσχει από δέκα (10) σοβαρότατα προβλήματα, τα οποία θα περιγράψουμε και θα εξηγήσουμε λεπτομερέστερα στις ακόλουθες ενότητες.
Το πρώτο και σημαντικό ζήτημα είναι ότι το νέος κορονοϊός SARS-CoV-2 (στη υπό αξιολόγηση εργασία εμφανίζεται με την ονομασία 2019-nCoV και τον Φεβρουάριο του 2020 με τίτλο SARS-CoV-2 από μια διεθνή κοινοπραξία εμπειρογνωμόνων ιολόγων) βασίζεται σε in-silico γενετικές αλληλουχίες (δηλαδή γενετικές αλληλουχίες κατασκευασμένες με τη χρήση Ηλεκτρονικού Υπολογιστή) , που παρασχέθηκαν από ένα εργαστήριο στην Κίνα [1], διότι εκείνη τη στιγμή δεν ήταν διαθέσιμο στους συγγραφείς, δείγμα ελέγχου από μολυσματικό («ζωντανό») ή αδρανοποιημένου SARS-CoV-2 ούτε απομονωμένο γονιδιωματικό RNA του ιού. Μέχρι σήμερα, δεν έχει λάβει χώρα ο απαιτούμενος έλεγχος εγκυρότητας (validation) από τους συντάκτες της επίμαχης εργασίας βασισμένος σε απομονωμένους ιούς SARS-CoV-2 ή RNA πλήρους μήκους αυτών. Σύμφωνα με τους Corman et al .:
«Στόχος μας ήταν να σχεδιάσουμε και να αναπτύξουμε μια ισχυρή διαγνωστική μεθοδολογία για χρήση σε εργαστήρια δημόσιας υγείας χωρίς να διαθέτουμε στελέχη ιών (ιϊκό υλικό)». [1]
Πρέπει να εστιάσουμε στους δύο δηλωθέντες στόχους: α) σχεδιασμός και β) ανάπτυξη διαγνωστικού τεστ για χρήση σε εργαστήρια δημόσιας υγείας .
Αυτοί οι στόχοι δεν είναι εφικτοί χωρίς να υπάρχει διαθέσιμο πραγματικό υλικό ιού (π.χ. για τον προσδιορισμό του μολυσματικού ιϊκού στελέχους). Σε κάθε περίπτωση, μόνον ένα πρωτόκολλο με μέγιστη ακρίβεια μπορεί να είναι ο επιτακτικός και πρωταρχικός στόχος σε οποιοδήποτε σενάριο-αποτέλεσμα αυτού του μεγέθους. Ο κρίσιμος προσδιορισμός του ιϊκού φορτίου είναι υποχρεωτική και αναγκαία πληροφορία και είναι ευθύνη της ομάδας του Christian Drosten να πραγματοποιήσει αυτά τα πειράματα και να παράσχει τα κρίσιμα δεδομένα.
Παρ’ όλα αυτά, αυτές οι αλληλουχίες in silico (κατασκευασμένες με υπολογιστή) χρησιμοποιήθηκαν για την ανάπτυξη μεθοδολογίας τεστ RT-PCR για τον προσδιορισμό του προαναφερθέντος ιού. Αυτό το μοντέλο βασίστηκε στην υπόθεση ότι ο νέος ιός είναι παραπλήσιος με τον SARS-CoV από το 2003 καθώς και οι δύο τους είναι βήτα-κορονοϊοί.
Η δοκιμή PCR λοιπόν σχεδιάστηκε χρησιμοποιώντας τη γονιδιωματική αλληλουχία του SARS-CoV ως υλικό ελέγχου για το συστατικό Sarbeco ( εκκινητές) και αυτό το γνωρίζουμε από την προσωπική μας ηλεκτρονική επικοινωνία με [2] έναν από τους συν-συγγραφείς της εργασίας Corman-Drosten. Αυτή η μέθοδος μοντελοποίησης του SARS-CoV-2 περιεγράφηκε στην εργασία Corman-Drosten ως εξής:
« Η καθιέρωση και επικύρωση μιας διαγνωστικής ροής εργασίας για τον έλεγχο του 2019-nCoV και συγκεκριμένης επιβεβαίωσης, σχεδιάσθηκε ελλείψει διαθέσιμων απομονωμένων ιών ή πρωτότυπων δειγμάτων ασθενών. Ο σχεδιασμός και η επικύρωση κατέστησαν δυνατοί λόγω της στενής γενετικής σχέσης με το SARS-CoV του 2003 και υποβοηθήθηκε από τη χρήση της τεχνολογίας των συνθετικών νουκλεϊκών οξέων. "
Η PCR Αντίστροφης Μεταγραφης (Reverse Transcription-Polymerase Chain Reaction-RT-PCR) είναι μια σημαντική βιομοριακή τεχνολογία για την ταχεία ανίχνευση σπάνιων RNA θραυσμάτων, των οποία οι γενετικές αλληλουχίες είναι ΓΝΩΣΤΕΣ ΕΚ ΤΩΝ ΠΡΟΤΕΡΩΝ.
Στο πρώτο στάδιο, τα μόρια RNA που υπάρχουν στο δείγμα μεταγράφονται αντίστροφα και παράγουν cDNA. Το cDNA στη συνέχεια ενισχύεται στην αλυσιδωτή αντίδραση πολυμεράσης χρησιμοποιώντας ένα ειδικό ζεύγος εκκινητών και ένα ένζυμο θερμοσταθερής DΝΑ πολυμεράσης. Η τεχνολογία αυτή είναι εξαιρετικά ευαίσθητη και το όριο ανίχνευσής της είναι θεωρητικά 1 μόριο cDNA.
Η εξειδίκευση (specificity) του PCR επηρεάζεται σε μεγάλο βαθμό από σφάλματα βιομοριακού σχεδιασμού.
Τι είναι σημαντικό κατά το σχεδιασμό ενός τεστ RT-PCR και του ποσοτικού τεστ RT-qPCR που περιγράφεται στη δημοσίευση Corman-Drosten;
1. Οι εκκινητές (primers) και οι ανιχνευτές (probes):
α) η συγκέντρωση των εκκινητών και ανιχνευτών πρέπει να είναι βέλτιστου εύρους (100-200 ηΜ)
β) πρέπει να είναι εξειδικευμένοι (specific) για τον στόχο-γονιδίου (target gene) που θέλετε να ενισχύσετε (Σημ.: πρέπει να έχουν έτσι σχεδιαστεί ώστε να είναι απόλυτα συμπληρωματικά στα άκρα των γονιδιακών τόπων που μας ενδιαφέρουν.)
γ) πρέπει να έχουν βέλτιστο ποσοστό περιεκτικότητας GC σε σχέση με το σύνολο των αζωτούχων βάσεων (ελάχιστο 40%, μέγιστο 60%)
δ) για διαγνωστικά ιών, τουλάχιστον 3 ζεύγη εκκινητών πρέπει να ανιχνεύσουν 3 ιικά γονίδια (κατά προτίμηση όσο το δυνατόν μεγαλύτερης απόστασης στο ιικό γονιδίωμα)
2. Η θερμοκρασία με την οποία λαμβάνουν χώρα όλες οι αντιδράσεις:
α) Θερμοκρασία τήξης DNA (> 92 °)
β) Θερμοκρασία ενίσχυσης DNA (ειδική TaqPol)
- c) Tm; η θερμοκρασία υβριδισμού - annealing temperature (η θερμοκρασία στην οποία οι εκκινητές και οι ανιχνευτές φθάνουν στο στόχο σύνδεσης / αποκόλλησης, να μην υπερβαίνει τους 2 ̊C ανά ζεύγος εκκινητών). H Tm εξαρτάται σε μεγάλο βαθμό από τπεριεκτικότητα σε GC των εκκινητών
3. Ο αριθμός των κύκλων ενίσχυσης (μικρότερος των 35 · κατά προτίμηση 25-30 κύκλοι).
Σε περίπτωση ανίχνευσης ιών, περισσότεροι από 35 κύκλοι ανιχνεύουν μόνο σήματα που δεν συσχετίζονται με μολυσματικό ιό όπως αυτό προσδιορίζεται από την απομόνωση στην κυτταρική καλλιέργεια [αναθεωρείται στο 2]. εάν κάποιος έχει «διαγνωσθεί» από τη μέθοδο PCR ως «θετικός» όταν χρησιμοποιείται ένα κατώφλι 35 κύκλων ή υψηλότερο*** (όπως συμβαίνει στα περισσότερα εργαστήρια στην Ευρώπη και τις ΗΠΑ), η πιθανότητα ότι το εν λόγω άτομο να είναι πραγματικά μολυσμένο είναι μικρότερη από 3%, η πιθανότητα ότι το εν λόγω αποτέλεσμα είναι ψευδώς θετικό είναι 97% [αναθεωρήθηκε σε 3]
***(Σημ.: H τιμή Ct αντιστοιχεί στον κύκλο κατά τον οποίο ο φθορισμός ξεπερνά το κατώφλι ανίχνευσης.)
4. Μοριακές βιολογικές επιβεβαιώσεις. Τα ενισχυμένα προϊόντα PCR πρέπει να επιβεβαιωθούν είτε με την διαδικασία των προϊόντων σε gel με χάρακα DNA, είτε με άμεση αλληλούχιση DNA
5. Πρέπει να καθοριστούν θετικοί και αρνητικοί έλεγχοι για την επιβεβαίωση / απόρριψη της ανίχνευσης συγκεκριμένων ιών
6. Πρέπει να υπάρχει ενεργή μια Τυποποιημένη Διαδικασία Λειτουργίας-ΤΔΛ (SOP-Standard Operational Procedure)
Η ΤΔΛ καθορίζει ξεκάθαρα τις παραπάνω παραμέτρους, έτσι ώστε όλα τα εργαστήρια να μπορούν να ρυθμίσουν τις ίδιες ακριβώς συνθήκες δοκιμής. Η ύπαρξη επικυρωμένου καθολικού SOP είναι απαραίτητη, διότι επιτρέπει τη σύγκριση δεδομένων εντός και μεταξύ χωρών.
ΕΛΛΑΣΣΟΝΕΣ ΠΡΟΒΛΗΜΑΤΙΣΜΟΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗ ΜΕΛΕΤΗ Corman-Drosten
- Στον Πίνακα 1 της εργασίας Corman-Drosten, αναφέρονται διαφορετικές συντομογραφίες - καθορίζεται το "nM", και όχι το "nm". Περαιτέρω όσον αφορά τη σωστή ονοματολογία, το nm σημαίνει "νανόμετρο" επομένως το nm έπρεπε να ήταν αντί nM.
- Είναι γενική συναίνεση να γράφονται οι γενετικές αλληλουχίες πάντα προς την κατεύθυνση 5'-3 ', συμπεριλαμβανομένων των αντίστροφων εκκινητών. Είναι εξαιρετικά ασυνήθιστο να κάνουμε ευθυγράμμιση με την αντίστροφη συμπληρωματική γραφή της αλληλουχίας εκκινητών, όπως έκαναν οι συγγραφείς στο σχήμα 2 της εργασίας Corman-Drosten. Εδώ, επιπλέον, μια αδιευκρίνιστη βάση σημειώνεται ως «y» χωρίς περιγραφή των βάσεων που σημαίνει το Υ.
- Δύο αποπροσανατολιστικά σφάλματα της εργασίας Corman-Drosten είναι ότι ο Πίνακας 1 δεν περιλαμβάνει τιμές της Tm (τιμές θερμοκρασίας υβριδισμού), ούτε παρουσιάζει δείχνει τιμές GC (αριθμός των G και C στις αλληλουχίες ως % -ποσοστό επί των συνολικών βάσεων).
ΜΕΙΖΟΝΕΣ ΠΡΟΒΛΗΜΑΤΙΣΜΟΙ ΣΧΕΤΙΚΑ ΜΕ ΤΗ ΜΕΛΕΤΗ Corman-Drosten
Α) ΥΠΟΒΑΘΡΟ
Οι συγγραφείς εισάγουν το ιστορικό του επιστημονικού τους έργου ως: «Το συνεχιζόμενο ξέσπασμα του πρόσφατα αναδυόμενου νέου κορονοϊού (2019-nCoV) αποτελεί πρόκληση για τα εργαστήρια δημόσιας υγείας καθώς απομονωθέντα στελέχη απομονωθέντων του ιού δεν είναι διαθέσιμα ενώ υπάρχουν αυξανόμενες ενδείξεις ότι η επιδημία είναι πιο διαδεδομένη από ότι αρχικά θεωρήθηκε, και η διεθνής εξάπλωση της μέσω των ταξιδιωτών έχει ήδη λάβει χώρα».
Σύμφωνα με το BBC News [4] και το Google Statistics [5], υπήρξαν έξι (6) θάνατοι παγκοσμίως στις 21 Ιανουαρίου 2020 - την ημέρα που υποβλήθηκε το χειρόγραφο.
Γιατί και με ποιο σκεπτικό οι συγγραφείς υπέθεσαν ότι υφίσταται μια πρόκληση για τα εργαστήρια δημόσιας υγείας, ενώ δεν υπήρχαν ουσιαστικά στοιχεία εκείνη την εποχή που να δείχνουν ότι το ξέσπασμα ήταν πιο διαδεδομένο από ό,τι αρχικά πιστευόταν;
Οι συγγραφείς δήλωσαν ότι σκοπός τους ήταν να σχεδιάσουν και να αναπτύξουν μια ισχυρή διαγνωστική μεθοδολογία για χρήση σε εργαστήρια δημόσιας υγείας χωρίς όμως να διαθέτουν υλικό του ιού (στελέχη). Επιπλέον, αναγνωρίζουν ότι: «Η παρούσα μελέτη καταδεικνύει την τεράστια ικανότητα ανταπόκρισης που επιτεύχθηκε μέσω του συντονισμού ακαδημαϊκών και δημόσιων εργαστηρίων σε εθνικά και ευρωπαϊκά ερευνητικά δίκτυα».
Β) ΜΕΘΟΔΟΙ ΚΑΙ ΑΠΟΤΕΛΕΣΜΑΤΑ
1. Σχεδίαση των εκκινητών και ανιχνευτών (Primers & Probes)
1α) Εσφαλμένες συγκεντρώσεις εκκινητών
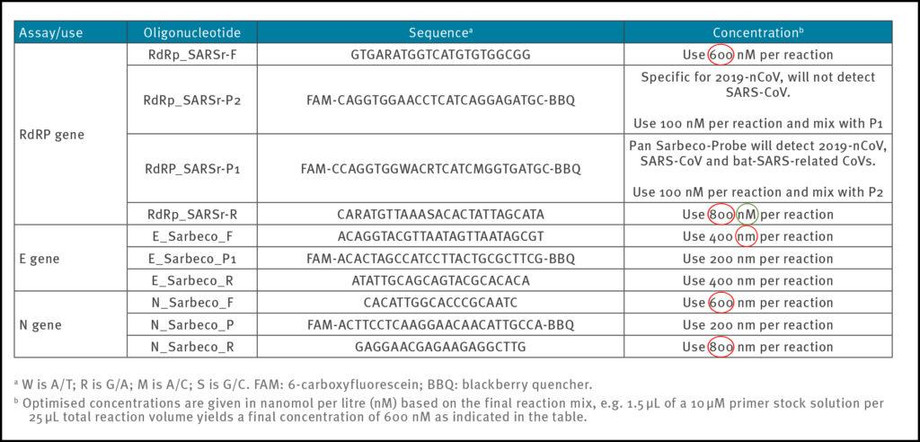
Τα αξιόπιστα και ακριβή πρωτόκολλα των τεστ PCR συνήθως σχεδιάζονται χρησιμοποιώντας συγκέντρωση μεταξύ 100 nM και 200 nM ανά εκκινητή [7]. Στην εργασία Corman-Drosten, παρατηρούμε ασυνήθιστα υψηλές και ποικίλες συγκεντρώσεις για αρκετούς εκκινητές (πίνακας 1). Για τα ζεύγη εκκινητών RdRp_SARSr-F και RdRp_SARSr-R, αναφέρονται 600 nM και 800 nM, αντίστοιχα. Ομοίως, για το σετ εκκινητών N_Sarbeco_F και N_Sarbeco_R, συνιστά, η μελέτη Corman-Drosten, 600 nM και 800 nM, αντίστοιχα [1].
Πρέπει να είναι σαφές ότι αυτές οι συγκεντρώσεις είναι πολύ υψηλές για να είναι βέλτιστες για συγκεκριμένες ενισχύσεις των γονιδίων-στόχων (target genes). Δεν υπάρχει συγκεκριμένος λόγος για τη χρήση αυτών των εξαιρετικά υψηλών συγκεντρώσεων εκκινητών σε αυτό το πρωτόκολλο. Αντίθετα, αυτές οι συγκεντρώσεις οδηγούν σε αυξημένo μη ειδικό υβριδισμό (unspecific binding) και μη-ειδική ενίσχυση του προϊόντος PCR.
Πίνακας 1: Εκκινητές και ανιχνευτές (βάσει της εργασίας Corman-Drosten. Επισημαίνονται οι εσφαλμένες συγκεντρώσεις εκκινητών)
1β) Απροσδιόριστες ("ακαθόριστες-Wobbly") αλληλουχίες εκκινητών και ανιχνευτών
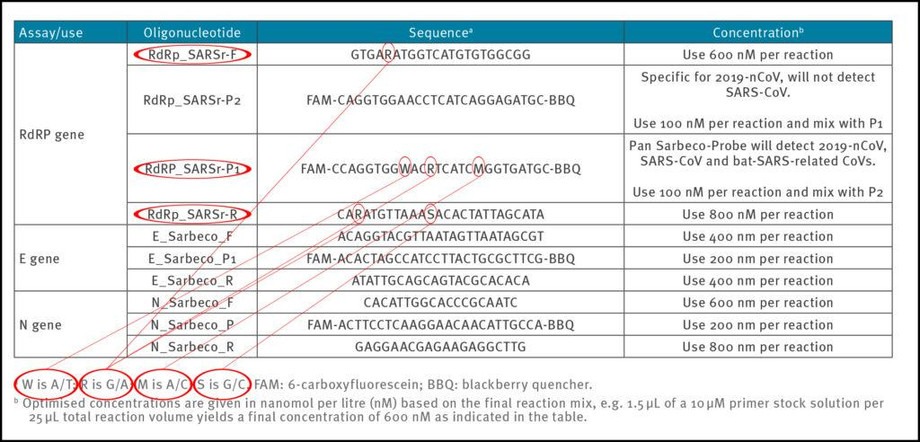
Για να παραχθούν αναπαραγώγιμα και συγκρίσιμα αποτελέσματα, είναι σημαντικό να ορισθούν ξεχωριστά τα ζεύγη εκκινητών. Στην εργασία Corman-Drosten παρατηρήσαμε έξι (6) μη καθορισμένες θέσεις, που υποδεικνύονται με τα γράμματα R, W, M και S (Πίνακας 2). Το γράμμα W σημαίνει ότι σε αυτήν τη θέση μπορεί να υπάρχει είτε Α ή Τ · το R σημαίνει ότι μπορεί να υπάρχει είτε G είτε A. Το Μ υποδηλώνει ότι η θέση μπορεί να είναι Α ή Γ· το γράμμα S δείχνει ότι μπορεί να υπάρχει είτε G είτε C σε αυτήν τη θέση.
Αυτός ο μεγάλος αριθμός παραλλαγών όχι μόνον είναι ασυνήθιστος, αλλά είναι επίσης πολύ συγκεχυμένος για τα εργαστήρια. Αυτές οι έξι (6) απροσδιόριστες θέσεις θα μπορούσαν εύκολα να οδηγήσουν στο σχεδιασμό πολλών διαφορετικών εναλλακτικών αλληλουχιών εκκινητών που δεν σχετίζονται με τον SARS-CoV-2 (2 διακριτοί εκκινητές RdRp_SARSr_F + 8 διακριτοί ανιχνευτές RdRp_SARS_P1 + 4 διακριτοί RdRp_SARSr_R). Οι παραλλαγές σχεδιασμού (των εκκινητών) θα οδηγήσουν αναπόφευκτα σε αποτελέσματα που δεν σχετίζονται ούτε με το SARS CoV-2. Επομένως, η συγκεχυμένη μη-ειδική περιγραφή στη μελέτη Corman-Drosten δεν είναι κατάλληλη ως Τυποποιημένη Διαδικασία Λειτουργίας-ΤΔΛ. Αυτές οι απροσδιόριστες θέσεις θα έπρεπε να είχαν σχεδιαστεί κατηγορηματικά και με σαφήνεια.
Αυτές οι ακαθόριστες αλληλουχίες έχουν ήδη δημιουργήσει μια πηγή ανησυχίας στους επιστήμονες και οδήγησαν σε μια επιστολή προς τον συντάκτη που συνέταξε οι Pillonel et al. [8] σχετικά με τα κατάφωρα σφάλματα στις περιγραφόμενες αλληλουχίες. Αυτά τα σφάλματα είναι αυταπόδεικτα και στο Παράρτημα επίσης της εργασίας Corman et al.
Πίνακας 2: Εκκινητές και ανιχνευτές (προσαρμοσμένοι στην εργασία Corman-Drosten · επισημαίνονται τα μη-καθορισμένα ("Wobbly") νουκλεοτίδια στους εκκινητές)
Το πρωτόκολλο του ΠΟΥ (Σχήμα 1), το οποίο βασίζεται εξ ολοκλήρου στην εργασία Corman-Drosten, καταλήγει στο συμπέρασμα ότι για να επιβεβαιωθεί η παρουσία του SARS-CoV-2, πρέπει να προσδιοριστούν δύο γονίδια ελέγχου (τα γονίδια E-και RdRp) στην ανάλυση. Θα πρέπει να σημειωθεί, ότι το RdPd-γονίδιο έχει μία αβέβαιη θέση («ακαθόριστη») στον εμπρόσθιο εκκινητή (R = G / A), δύο αβέβαιες θέσεις στον αντίστροφο εκκινητή (R = G / A, S = G / C) και έχει τρεις αβέβαιες θέσεις στον RdRp-probe (W = A / T, R = G / A, M = A / C). Έτσι, δύο διαφορετικοί εμπρόσθιοι εκκινητές, τέσσερις διαφορετικοί αντίστροφοι εκκινητές και οκτώ διαφορετικοί ανιχνευτές μπορούν να συντεθούν για το RdPd-γονίδιο. Αθροιστικά, υπάρχουν 64 πιθανοί συνδυασμοί εκκινητών και ανιχνευτών!
Το έγγραφο Corman-Drosten προσδιορίζει περαιτέρω ένα τρίτο γονίδιο το οποίο, σύμφωνα με το πρωτόκολλο της ΠΟΥ, δεν επικυρώθηκε περαιτέρω και θεωρήθηκε περιττό:
"Σημειωτέον, η ανάλυση του γονιδίου Ν είχε επίσης καλή απόδοση, αλλά δεν υποβλήθηκε σε περαιτέρω εντατική επαλήθευση επειδή ήταν ελαφρώς λιγότερο ευαίσθητο."
Αυτή ήταν μια ατυχής παράλειψη, καθώς θα ήταν καλύτερο να χρησιμοποιηθούν όλα τα τρία γονίδια ως επιβεβαιωτικές αναλύσεις της PCR, και αυτό θα είχε ως αποτέλεσμα ένα σχεδόν επαρκές πρωτόκολλο διαγνωστικού εργαλείου ανίχνευσης RNA ενός ιού. Τρείς επιβεβαιωτικές αναλύσεις, τριών βημάτων, θα ελαχιστοποιούσαν τουλάχιστον τα σφάλματα και τις αβεβαιότητες σε κάθε στάδιο όσον αφορά τα «ακαθόριστα» σημεία. (Ακόμα και έτσι, το πρωτόκολλο θα εξακολουθούσε να στερείται οποιασδήποτε «καλής εργαστηριακής πρακτικής», όταν συνυπολογίζονται και όλα τα άλλα σχεδιαστικά ελαττώματα).
Ως έχει, η ανάλυση του Ν-γονιδίου δεν προτείνεται δυστυχώς ούτε στη σύσταση του ΠΟΥ (Σχήμα 1) ως υποχρεωτικό και κρίσιμο τρίτο επιβεβαιωτικό βήμα, ούτε τονίζεται στο έγγραφο Corman-Drosten ως σημαντική προαιρετική διαβεβαίωση «για μια ροή εργασιών ρουτίνας» (Πίνακας 2).
Κατά συνέπεια, σε όλες σχεδόν τις διαδικασίες των τεστ σε όλο τον κόσμο, χρησιμοποιήθηκαν μόνο δύο (2) ζεύγη εκκινητών αντί για όλους τους τρεις. Αυτή η παράλειψη καθιστά ολόκληρο το πρωτόκολλο του τεστ, άχρηστο, όσον αφορά την παροχή ακριβών αποτελεσμάτων ακριβείας με πραγματική διαγνωστική αξία για ένα τεστ σε μια συνεχιζόμενη πανδημία.
Σχήμα 1: Η επιβεβαιωτική ανάλυση του N-γονιδίου δεν τονίζεται από τον ΠΟΥ ως απαραίτητο τρίτο βήμα στην επίσημη σύσταση του ως πρωτοκόλλου της εργασίας Drosten-Corman [παρακάτω 8] ούτε απαιτείται ως κρίσιμο βήμα για την υψηλότερη ακρίβεια του τεστ στη δημοσίευση της Eurosurveillance.
1c) Λάθος περιεχόμενο GC (συζητείται στο 2c, μαζί με τη θερμοκρασία υβριφδισμού (Tm))
1δ) Ανίχνευση ιικών γονιδίων
Η RT-PCR δεν συνιστάται για πρωτογενή διάγνωση λοίμωξης. Γι 'αυτό το τεστ RT-PCR που χρησιμοποιείται στην κλινική ρουτίνα για την ανίχνευση του COVID-19 δεν ενδείκνυται για διάγνωση COVID-19 σε κανονιστική βάση.
«Οι γιατροί πρέπει να αναγνωρίζουν την βελτιωμένη ακρίβεια και ταχύτητα των μοριακών διαγνωστικών τεχνικών για τη διάγνωση λοιμώξεων, αλλά και να κατανοήσουν τους περιορισμούς τους. Τα εργαστηριακά αποτελέσματα πρέπει πάντα να ερμηνεύονται στο πλαίσιο της κλινικής παρουσίασης του ασθενούς και απαιτείται κατάλληλη τοποθεσία, ποιότητα και χρόνος συλλογής δειγμάτων για αξιόπιστα αποτελέσματα των δοκιμών / τεστ ». [9]
Ωστόσο, μπορεί να χρησιμοποιηθεί για να βοηθήσει τη διαφορική διάγνωση του γιατρού όταν πρέπει να κάνει διάκριση μεταξύ διαφορετικών λοιμώξεων του πνεύμονα (η γρίπη, το Covid-19 και το SARS έχουν πολύ παρόμοια συμπτώματα). Για επιβεβαιωτική διάγνωση ενός συγκεκριμένου ιού, πρέπει να εφαρμόζονται τουλάχιστον τρία (3) συγκεκριμένα ζεύγη εκκινητών για την ανίχνευση τριών (3) ειδικών για τον ιό γονιδίων. Κατά προτίμηση, αυτά τα γονίδια-στόχοι πρέπει να εντοπίζονται με τη μεγαλύτερη δυνατή απόσταση στο ιικό γονιδίωμα (περιλαμβανομένων των αντιθέτων άκρων).
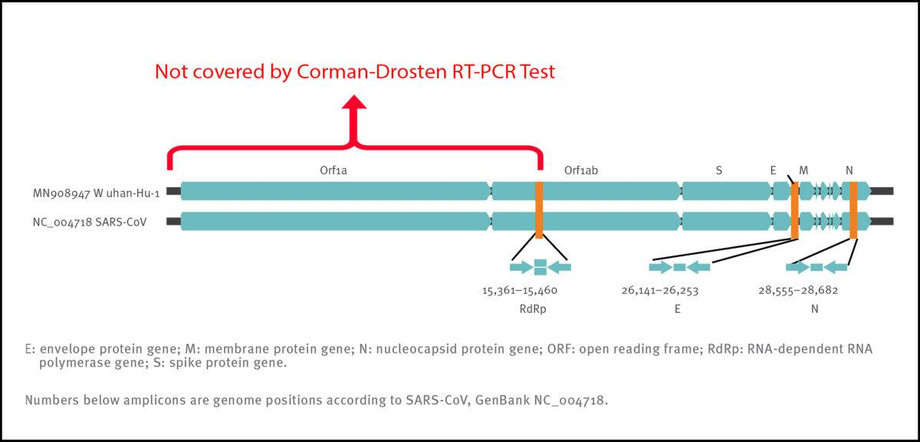
Αν και το έγγραφο Corman-Drosten περιγράφει τρείς (3) εκκινητές, αυτοί οι εκκινητές καλύπτουν μόνο το ήμισυ, περίπου, του γονιδιώματος του ιού. Αυτός είναι ένας άλλος παράγοντας που μειώνει την ειδικότητα για την ανίχνευση ανέπαφου RNA του ιού SARS-COV-2 και αυξάνει την αναφορά ψευδώς θετικών αποτελεσμάτων των δοκιμών/τεστ.
Επομένως, ακόμη και αν λάβουμε τρία θετικά σήματα (δηλαδή τα τρία ζεύγη εκκινητών δίνουν τρία (3) διαφορετικά προϊόντα ενίσχυσης) σε ένα δείγμα, αυτό δεν αποδεικνύει την παρουσία ιού. Ένας καλύτερος σχεδιασμός εκκινητών θα είχε τερματικούς εκκινητές και στα δύο άκρα του ιικού γονιδιώματος. Αυτό συμβαίνει επειδή ολόκληρο το ιικό γονιδίωμα θα καλυπτόταν και τρία θετικά σήματα μπορούν καλύτερα να διακρίνουν μεταξύ ενός πλήρους (και επομένως δυνητικά μολυσματικού) ιού και των κατακερματισμένων ιογενών γονιδιωμάτων (χωρίς μολυσματική ισχύ). Προκειμένου να συναχθεί κάτι σημαντικό σχετικά με τη μολυσματικότητα του ιού, το γονίδιο Orf1, το οποίο κωδικοποιεί το βασικό ένζυμο ρεπλικάσης των ιών SARS-CoV, θα έπρεπε να είχε συμπεριληφθεί ως στόχος (Σχήμα 2). Η τοποθέτηση των στόχων στην περιοχή του ιικού γονιδιώματος που μεταγράφεται περισσότερο και μεταβλητά είναι μια άλλη αδυναμία του πρωτοκόλλου.
Στην εργασία Kim et al. παρουσιάζεται στο 3’ μια πολύ μεταβλητή έκφραση του υπογονιδιωματικού RNA στο Sars-CoV-2 [23]. Αυτά τα RNA παρακολουθούνται ενεργά ως υπογραφές για ασυμπτωματικούς και μη μολυσματικούς ασθενείς [10]. Είναι πολύ αμφισβητήσιμο να ελέγχεται ένας πληθυσμός ασυμπτωματικών ατόμων με εκκινητές qPCR που έχουν έξι (6) ζεύγη βάσεων διμερών εκκινητών στο 3’ πρωταρχικό άκρο ενός εκκινητή (Σχήμα 3).
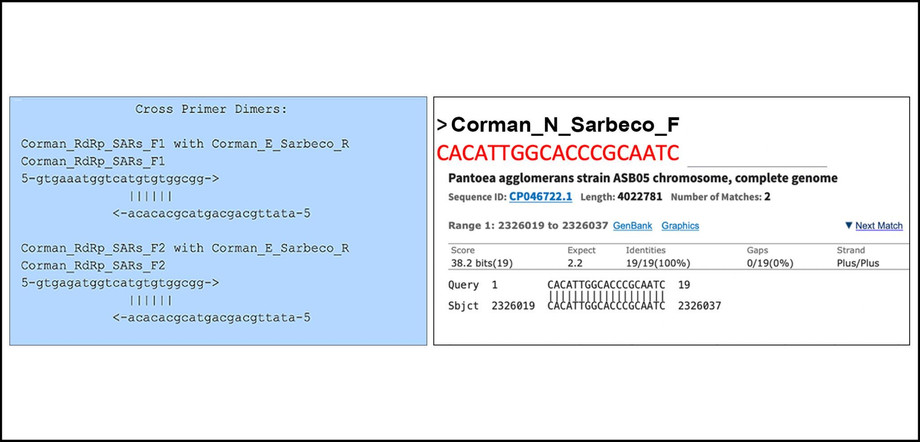
Προφανώς ο ΠΟΥ συνιστά αυτούς τους εκκινητές. Αναλύσαμε όλα τα ασταθή παράγωγα από την εργασία Corman-Drosten με το διαδικτυακό εργαλείο διμερούς εκκινητή της Thermofisher [11]. Ο εμπρόσθιος εκκινητής του RdRp έχει 6bp 3’ prime ομολογία με τον Sarbeco E Reverse. Σε υψηλές συγκεντρώσεις εκκινητών, αυτό αρκεί για να παράξει ανακρίβειες.
Σημείωση: Υπάρχει ένας τέλειος συνδυασμός ενός από τους Ν εκκινητές με ένα κλινικό παθογόνο (Pantoea), που συναντάται σε ανοσοκατασταλμένους ασθενείς. Ο αντίστροφος εκκινητής συμπίπτει επίσης με την Pantoea αλλά όχι στην ίδια περιοχή (Σχήμα 3).
Αυτά είναι σοβαρά σφάλματα σχεδιασμού, καθώς το τεστ δεν μπορεί να κάνει διάκριση μεταξύ ολόκληρου του ιού και των ιογενών θραυσμάτων. Το τεστ δεν μπορεί να χρησιμοποιηθεί ως διαγνωστικό για τους ιούς SARS.
Σχήμα 2: Σχετικές θέσεις στόχων αμπλικονίου στον SARS coronavirus και το νέο γονιδίωμα coronavirus του 2019. ORF: ανοιχτό πλαίσιο ανάγνωσης. RdRp: RNA-εξαρτώμενη RNA πολυμεράση. Οι αριθμοί κάτω από το αμπλικόνιο είναι θέσεις γονιδιώματος σύμφωνα με το SARS-CoV, NC_004718 [1].
Σχήμα 3: Μια ανάλυση με το εργαλείο διμερών εκκινητών Thermofischer αποκαλύπτει ότι ο μπροστινός εκκινητής RdRp έχει ομολογία 6bp 3 "με το Sarbeco E Reverse (αριστερό πλαίσιο). Μια άλλη ανάλυση αποκαλύπτει ότι υπάρχει ένας τέλειος συνδυασμός για έναν από τους Ν-εκκινητές με ένα κλινικό παθογόνο (Pantoea) που βρίσκεται σε ανοσοκατασταλμένους ασθενείς (δεξί κουτί)
2. Θερμοκρασίες αντίδρασης
2α) Θερμοκρασία τήξης DNA (> 92 °).
Αντιμετωπίζονται κατάλληλα στο έγγραφο Corman-Drosten.
2β) Θερμοκρασία ενίσχυσης DNA.
Αντιμετωπίζονται κατάλληλα στο έγγραφο Corman-Drosten.
2c) Λάθος περιεχόμενα GC και Tm
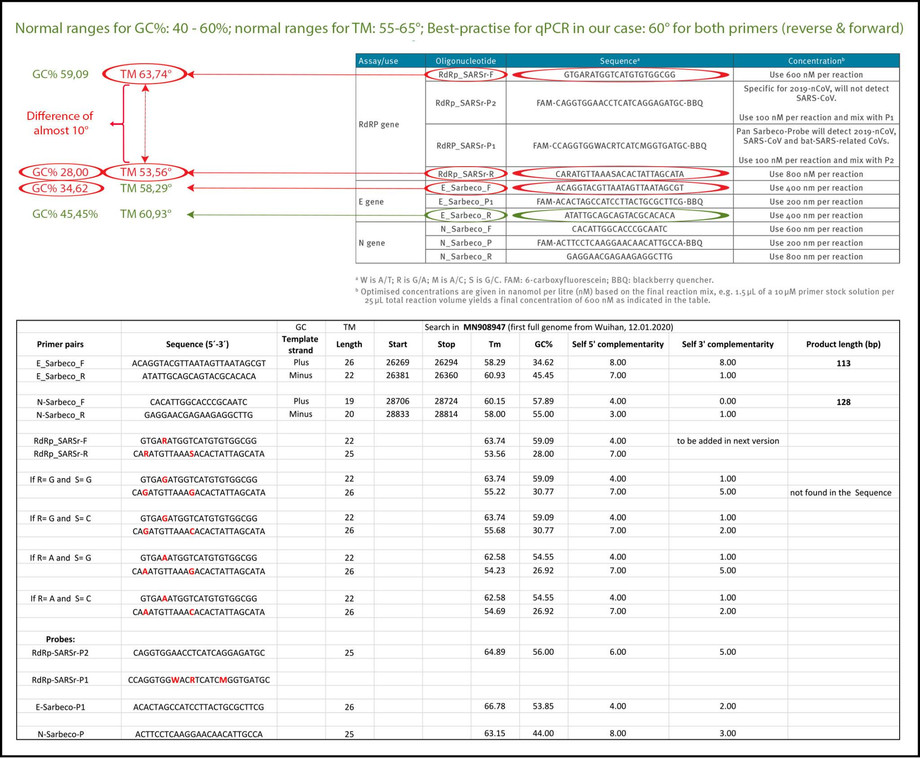
Η θερμοκρασία υβριδισμού καθορίζει σε ποια θερμοκρασία προσκολλάται / αποσπάται ο εκκινητής στην/ από την αλληλουχία στόχο. Για αποτελεσματική και ειδική ενίσχυση, το περιεχόμενο GC των εκκινητών πρέπει να επιτυγχάνειενίσχυση της τάξης μεταξύ, τουλάχιστον 40% και μέγιστο 60%. Όπως αναφέρεται στον πίνακα 3, τρείς από τους εκκινητές που περιγράφονται στην εργασία Corman-Drosten δεν βρίσκονται εντός του φυσιολογικού εύρους για περιεχόμενο GC. Δύο εκκινητές (RdRp_SARSr_F και RdRp_SARSr_R) έχουν ασυνήθιστες και πολύ χαμηλές τιμές GC 28% -31% για όλες τις πιθανές παραλλαγές ασταθών βάσεων, ενώ ο εκκινητής E_Sarbeco_F έχει τιμή GC 34,6% (Πίνακας 3 και δεύτερο πίνακα του Πίνακα 3) .
Θα πρέπει να σημειωθεί ότι το περιεχόμενο GC καθορίζει σε μεγάλο βαθμό τη δέσμευση στον συγκεκριμένο στόχο λόγω των τριών δεσμών υδρογόνου στο ζεύγος βάσεων του. Έτσι, όσο χαμηλότερη είναι η περιεκτικότητα GC του εκκινητή, τόσο χαμηλότερη είναι η ικανότητα δέσμευσής της με την συγκεκριμένη αλληλουχία γονιδίου στόχου (δηλαδή το γονίδιο που θα ανιχνευθεί). Αυτό σημαίνει ότι για να αναγνωριστεί μια αλληλουχία-στόχος, πρέπει να επιλέξουμε μια θερμοκρασία που να είναι όσο το δυνατόν πιο κοντά στην πραγματική θερμοκρασία υβριδισμού (βέλτιστη πρακτική-τιμή) για να μην αποκολληθεί ξανά ο εκκινητής, ενώ ταυτόχρονα επιλέγεται συγκεκριμένα η αλληλουχία-στόχου.
Εάν η τιμή Tm είναι πολύ χαμηλή, όπως παρατηρήθηκε για όλες τις παραλλαγές-ασταθών των αντίστροφων εκκινητών RdRp, οι εκκινητές μπορούν να δεσμεύονται σε μη-ειδικούς, διάφορους, στόχους, μειώνοντας την ειδικότητα και αυξάνοντας τα πιθανά ψευδώς θετικά αποτελέσματα.
Η θερμοκρασία υβριδισμού (Tm) είναι ένας κρίσιμος παράγοντας για τον προσδιορισμό της ειδικότητας / ακρίβειας της διαδικασίας qPCR και απαραίτητη για την αξιολόγηση της ακρίβειας των πρωτοκόλλων qPCR.
Σύσταση βέλτιστης πρακτικής: Και οι δύο εκκινητές (εμπρόσθιος και αντίστροφος) πρέπει να έχουν σχεδόν παρόμοια τιμή, κατά προτίμηση την ίδια τιμή.
Χρησιμοποιήσαμε το δωρεάν διαθέσιμο λογισμικό σχεδιασμού εκκινητών Primer-BLAST [12, 25] για να αξιολογήσουμε τις τιμές βέλτιστης πρακτικής για όλους τους εκκινητές που χρησιμοποιούνται στην εργασία Corman-Drosten (Πίνακας 3). Προσπαθήσαμε να βρούμε μια τιμή Tm 60° C, ενώ ταυτόχρονα αναζητούσαμε την υψηλότερη δυνατή τιμή GC% για όλους τους εκκινητές. Μια μέγιστη διαφορά Tm 2° C εντός ζευγών εκκινητών θεωρήθηκε αποδεκτή. Δοκιμάζοντας τα ζεύγη εκκινητών που καθορίζονται στην εργασία Corman-Drosten, παρατηρήσαμε μια διαφορά 10° C σε σχέση με τη θερμοκρασία υβριδισμού Tm για το ζεύγος εκκινητών 1 (RdRp_SARSr_F και RdRp_SARSr_R). Αυτό είναι ένα πολύ σοβαρό σφάλμα και καθιστά το πρωτόκολλο άχρηστο ως ειδικό διαγνωστικό εργαλείο.
Πρόσθετες δοκιμές έδειξαν ότι μόνο το ζεύγος εκκινητών που έχει σχεδιαστεί για την ενίσχυση του γονιδίου N (N_Sarbeco_F και N_Sarbeco_R) έφτασε στο κατάλληλο πρότυπο για να λειτουργήσει σε διαγνωστικό έλεγχο, καθώς έχει επαρκές περιεχόμενο GC και η διαφορά Tm μεταξύ των εκκινητών (N_Sarbeco_F και N_Sarbeco_R ) είναι 1,85° C (κάτω από το κρίσιμο μέγιστο της διαφοράς 2° C). Το σημαντικότερο είναι ότι αυτό είναι το γονίδιο που δεν αναλύθηκε ούτε στα δείγματα ιών (Πίνακας 2) ούτε τονίστηκε ως επιβεβαιωτικό τεστ. Εκτός από τις εξαιρετικά μεταβλητές θερμοκρασίες τήξης και τις εκφυλισμένες αλληλουχίες σε αυτούς τους εκκινητές, υπάρχει ένας άλλος παράγοντας που επηρεάζει την ειδικότητα της διαδικασίας: οι dNTPs (0,4uM) είναι διπλάσια υψηλότερες από τις συνιστώμενες για μια ιδιαίτερα ειδική ενίσχυση. Επίσης έχει προστεθεί επιπλέον θειικό μαγνήσιο στην αντίδραση. Αυτή η διαδικασία σε συνδυασμό με χαμηλή θερμοκρασία υβριδισμού μπορεί να δημιουργήσει μη ειδικές ενισχύσεις. Όταν απαιτείται επιπλέον μαγνήσιο για τη qPCR, η ειδικότητα της ανάλυσης θα πρέπει να ελεγχθεί εξονυχιστικά.
Τα σφάλματα σχεδιασμού που περιγράφονται εδώ είναι τόσο σοβαρά που είναι πολύ απίθανο να προκύψει συγκεκριμένη ενίσχυση του γενετικού υλικού του SARS-CoV-2 χρησιμοποιώντας το πρωτόκολλο της εργασίας Corman-Drosten.
Πίνακας 3: Το περιεχόμενο GC των εκκινητών και ανιχνευτών (προσαρμοσμένο στην εργασία Corman-Drosten, επισημαίνονται οι παρεκκλίσεις από βελτιστοποιημένα περιεχόμενα GC. Το δεύτερο πλαίσιο δείχνει μια λίστα με όλες τις τιμές βέλτιστων πρακτικών Primer-BLAST για όλους τους εκκινητές και τους ανιχνευτές που χρησιμοποιούνται στο έγγραφο Corman-Drosten του καθηγητή Dr. Ulrike Kämmerer και της ομάδας της
3. Ο αριθμός των κύκλων ενίσχυσης
Θα πρέπει να σημειωθεί ότι δεν υπάρχει καμία αναφορά στην εργασία Corman-Drosten πότε ένα τεστ χαρακτηρίζεται ως θετικό ή αρνητικό, ή τι πράγματι είναι αυτό που ορίζει ένα αποτέλεσμα ως ένα θετικό ή αρνητικό. Αυτοί οι τύποι ιολογικών διαγνωστικών τεστ πρέπει να βασίζονται σε μια Τυποποιημένη Διαδικασία Λειτουργίας-ΤΔΛ (SOP), συμπεριλαμβανομένου ενός επικυρωμένου και σταθερού αριθμού κύκλων PCR (τιμή Ct) μετά τους οποίους ένα δείγμα θεωρείται θετικό ή αρνητικό. Η μέγιστη λογικά αξιόπιστη τιμή Ct είναι 30 κύκλοι. Πάνω από μια τιμή Ct των 35 κύκλων, πρέπει να αναμένεται ταχέως αυξανόμενος αριθμός ψευδών θετικών.
Τα δεδομένα της PCR που αξιολογούνται ως θετικά, μετά από τιμή Ct 35 κύκλων, είναι εντελώς αναξιόπιστα.
Παραπέμπουμε στους Jaafar et al. 2020 [3]: «Στη τιμή Ct = 35, η τιμή που χρησιμοποιούσαμε για να αναφέρουμε ένα θετικό αποτέλεσμα της PCR, διαπιστώθηκε ότι ποσοστό μικρότερο του 3% των καλλιεργειών είναι θετικές». Με άλλα λόγια, δεν υπήρξε επιτυχής απομόνωση του ιού του SARS-CoV-2 σε αυτές τις υψηλές τιμές Ct.
Περαιτέρω, επιστημονικές μελέτες δείχνουν ότι μόνο μη-μολυσματικοί (νεκροί) ιοί ανιχνεύονται με τιμές Ct 35 [22].
Μεταξύ 30 και 35 κύκλων υπάρχει μια γκρίζα περιοχή, όπου μια θετική δοκιμή δεν μπορεί να αποδειχθεί με βεβαιότητα. Αυτή η περιοχή πρέπει να αποκλειστεί. Φυσικά, μπορεί κανείς να εκτελέσει 45 κύκλους PCR, όπως συνιστάται στο πρωτόκολλο Corman-Drosten-WHO (ΠΟΥ) (Εικόνα 4), αλλά τότε πρέπει επίσης να ορίσετε μια λογική τιμή Ct (η οποία δεν θα πρέπει να υπερβαίνει τους 30). Όμως, ένα αναλυτικό αποτέλεσμα με τιμή Ct 45 είναι επιστημονικά και διαγνωστικά απολύτως χωρίς νόημα (μια λογική τιμή Ct δεν πρέπει να υπερβαίνει το 30). Όλα αυτά πρέπει να κοινοποιούνται πολύ καθαρά. Είναι σημαντικό λάθος το ότι η εργασία Corman-Drosten δεν αναφέρει τη μέγιστη τιμή Ct στην οποία ένα δείγμα μπορεί να θεωρηθεί αναμφίβολα ως θετικό ή αρνητικό αποτέλεσμα δοκιμής. Αυτό το σημαντικό όριο κύκλων (threshold) επίσης δεν καθορίζεται σε καμία νεώτερη υποβολή έως σήμερα.
Σχήμα 4: Σύσταση του κιτ RT-PCR στο επίσημο πρωτόκολλο Corman-Drosten-WHO (ΠΟΥ) [8]. Μόνο μια τιμή "Cycler" (κύκλοι) πρέπει να βρεθεί χωρίς αντίστοιχο και επιστημονικά λογικό όριο κύκλων Ct (Cutoff-value). Αυτή ή οποιαδήποτε άλλη τιμή όριου κύκλων δεν υπάρχει πουθενά στη πραγματική εργασία Corman-Drosten.
4. Βιομοριακές επικυρώσεις
Για να προσδιοριστεί εάν τα ενισχυμένα προϊόντα είναι πράγματι γονίδια SARS-CoV-2, είναι απαραίτητη η βιομοριακή επικύρωση των ενισχυμένων προϊόντων PCR. Για ένα διαγνωστικό τεστ, αυτή η επικύρωση είναι απολύτως αναγκαία.
Η επικύρωση των προϊόντων PCR πρέπει να εκτελείται είτε με την ανάλυση του προϊόντος της PCR σε 1% γέλη αγαρόζης-EtBr μαζί με ένδειξη μεγέθους (χάρακας DNA ή σκάλα DNA) έτσι ώστε να μπορεί να εκτιμηθεί το μέγεθος του προϊόντος. Το μέγεθος πρέπει να αντιστοιχεί στο υπολογισμένο μέγεθος του προϊόντος ενίσχυσης. Αλλά είναι ακόμα καλύτερο να αλληλουχίσετε το προϊόν ενίσχυσης. Το τελευταίο θα δώσει 100% βεβαιότητα σχετικά με την ταυτότητα του προϊόντος ενίσχυσης. Χωρίς μοριακή επικύρωση δεν μπορούμε να είμαστε σίγουροι για την ταυτότητα των ενισχυμένων προϊόντων PCR. Λαμβάνοντας υπόψη τα σοβαρά σφάλματα σχεδιασμού που περιεγράφηκαν νωρίτερα, τα ενισχυμένα προϊόντα PCR μπορεί να είναι οτιδήποτε.
Επίσης αυτό που δεν αναφέρεται στην εργασία Corman-Drosten είναι η περίπτωση μικρών θραυσμάτων qPCR (περίπου 100bp): Θα μπορούσε να είναι είτε 1,5% γέλη αγαρόζης είτε ακόμη και γέλη ακρυλαμιδίου.
Το γεγονός ότι αυτά τα προϊόντα PCR δεν έχουν επικυρωθεί σε μοριακό επίπεδο είναι ένα άλλο εντυπωσιακό σφάλμα του πρωτοκόλλου, καθιστώντας κάθε τεστ που βασίζεται σε αυτό άχρηστο ως ειδικό διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2.
5. Θετικοί και αρνητικοί έλεγχοι για επιβεβαίωση / αμφισβήτηση συγκεκριμένης ανίχνευσης ιών.
Η μη επιβεβαιωμένη υπόθεση που περιγράφεται στο έγγραφο Corman-Drosten είναι ότι το SARS-CoV-2 είναι ο μόνος ιός από την ομάδα β-κορανοϊού που μοιάζει με SARS και προκαλεί λοιμώξεις σε ανθρώπους. Οι αλληλουχίες στις οποίες βασίζεται η μέθοδος PCR είναι σε αλληλουχίες in silico (δλδ. κατασκευασμένες απο Ηλεκτρονικό Υπολογιστή), που παρασχέθηκαν από ένα εργαστήριο στην Κίνα [23], επειδή κατά τη στιγμή της ανάπτυξης του τεστ PCR δεν υπήρχε υλικό ελέγχου μολυσματικού («ζωντανού») ή αδρανοποιημένου SARS-CoV-2, διαθέσιμο στους συγγραφείς. Επομένως, η δοκιμή PCR σχεδιάστηκε χρησιμοποιώντας την ακολουθία του γνωστού SARS-CoV ως υλικού ελέγχου για το συστατικό Sarbeco (Dr. Meijer, συν-συγγραφέας Corman-Drosten σε ανταλλαγή email με τον Δρ. Peter Borger) [2].
Όλα τα άτομα που διαγιγνώσκονται θετικά με τη δοκιμή RT-PCR, όπως περιγράφεται στην εργασία Corman-Drosten, θεωρούνται θετικά για μολύνσεις SARS-CoV-2. Υπάρχουν τρία σοβαρά ελαττώματα στην υπόθεσή τους. Πρώτον, ένα θετικό τεστ για τα μόρια RNA που περιγράφονται στην εργασία Corman-Drosten δεν μπορεί να εξομοιωθεί με «μόλυνση από ιό». Ένα θετικό τεστ RT-PCR δείχνει απλώς την παρουσία μορίων RNA ιού. Όπως αποδεικνύεται στο σημείο 1δ (παραπάνω), το τεστ Corman-Drosten δεν σχεδιάστηκε για την ανίχνευση του ιού πλήρους μήκους, αλλά μόνο ενός τμήματος του ιού. Καταλήξαμε ήδη στο συμπέρασμα ότι αυτό κατατάσσει το τεστ ως ακατάλληλο ως διαγνωστικό τεστ για λοιμώξεις από ιούς SARS.
Δεύτερον και μείζονος σημασίας, η λειτουργικότητα του δημοσιευμένου τεστ RT-PCR δεν αποδείχθηκε με τη χρήση ενός θετικού μάρτυρα (απομονωμένο ιό και RNA του SARS-CoV-2) που είναι μια θεμελιώδης «Μέθοδος Αναφοράς» (Gold Standard).
Τρίτον, το έγγραφο Corman-Drosten αναφέρει:
«Για να δείξουμε ότι οι αναλύσεις μπορούν να ανιχνεύσουν άλλους ιούς-νυχτερίδας που σχετίζονται με το SARS, χρησιμοποιήσαμε τον προσδιορισμό γονιδίου Ε για να δοκιμάσουμε έξι δείγματα κοπράνων που προέρχονται από νυχτερίδες διαθέσιμα από τους Drexler et al. […] Und Muth et al. […]. Αυτά τα θετικά στον ιό δείγματα προέρχονταν από ευρωπαϊκές νυχτερίδες. Η ανίχνευση αυτών των φυλογενετικών άκρων στους κλαδους Cov του SARS υποδηλώνει ότι όλοι οι ασιατικοί ιοί είναι πιθανό να εντοπιστούν. Αυτό, θεωρητικά, θα εξασφάλιζε ευρεία ευαισθησία ακόμη και σε περίπτωση πολλαπλών ανεξάρτητων παραλλαγών ιών που θα μπορούσαμε να αποκτήσουμε από μια δεξαμενή ζώων.»
Αυτή η δήλωση αποδεικνύει ότι το γονίδιο Ε που χρησιμοποιήθηκε στη δοκιμή RT-PCR, όπως περιγράφεται στην εργασία Corman-Drosten, δεν είναι ειδικό για το SARS-CoV-2.
Οι εκκινητές γονιδίων Ε ανιχνεύουν επίσης ένα ευρύ φάσμα άλλων ιών SARS.
Το γονιδίωμα του κορονοϊού είναι ο μεγαλύτερος από όλους τους ιούς RNA που μολύνουν τον άνθρωπο και όλοι έχουν πολύ παρόμοια μοριακή δομή. Ωστόσο, το SARS-CoV1 και το SARS-CoV-2 έχουν δύο πολύ συγκεκριμένα γενετικά δακτυλικά αποτυπώματα, τα οποία τα ξεχωρίζουν από τους άλλους κορονοϊούς. Πρώτον, υπάρχει μια μοναδική ακολουθία δακτυλικών αποτυπωμάτων (KTFPPTEPKKDKKKK) στην Ν-πρωτεΐνη των SARS-CoV και SARS-CoV-2 [13,14,15]. Δεύτερον, τόσο το SARS-CoV1 όσο και το SARS-CoV2 δεν περιέχουν την πρωτεΐνη HE, ενώ όλοι οι άλλοι κορονοϊοί κατέχουν αυτό το γονίδιο [13, 14].Έτσι, για να εντοπιστεί συγκεκριμένα ένα προϊόν PCR των SARS-CoV1 και SARS-CoV-2, η παραπάνω περιοχή στο γονίδιο Ν θα έπρεπε να είχε επιλεγεί ως στόχος ενίσχυσης. Ένα αξιόπιστο διαγνωστικό τεστ θα πρέπει να επικεντρώνεται σε αυτήν τη συγκεκριμένη περιοχή στο γονίδιο Ν ως επιβεβαιωτικό τεστ. Το PCR για αυτό το γονίδιο Ν δεν επικυρώθηκε περαιτέρω ούτε συνιστάται ως γονίδιο δοκιμής από την εργασία Drosten-Corman, επειδή «δεν ήταν τόσο ευαίσθητο» με τον αρχικό ανιχνευτή SARS-CoV [1].
Επιπλέον, η απουσία του γονιδίου HE τόσο στο SARS-CoV1 όσο και στο SARS-CoV-2 καθιστά αυτό το γονίδιο τον ιδανικό αρνητικό έλεγχο για τον αποκλεισμό άλλων κορονοϊών. Η εργασία Corman-Drosten δεν περιέχει αυτόν τον αρνητικό έλεγχο, ούτε περιέχει άλλα αρνητικά στοιχεία ελέγχου. Το τεστ PCR στην εργασία Corman-Drosten επομένως δεν περιέχει ούτε ένα μοναδικό θετικό έλεγχο ούτε αρνητικό έλεγχο για να αποκλείσει την παρουσία άλλων κορονοϊών. Αυτό είναι ένα άλλο μεγάλο ελάττωμα σχεδιασμού που χαρακτηρίζει το τεστ ως ακατάλληλο για διάγνωση.
6. Η Τυποποιημένη Διαδικασία Λειτουργίας-ΤΔΛ (SOP) δεν είναι διαθέσιμη
Πρέπει να υπάρχει διαθέσιμη μια Τυποποιημένη Διαδικασία Λειτουργίας (SOP), η οποία να καθορίζει ξεκάθαρα τις παραπάνω παραμέτρους, έτσι ώστε όλα τα εργαστήρια να μπορούν να ρυθμίσουν ακριβώς τις ίδιες συνθήκες δοκιμής. Η ύπαρξη επικυρωμένου καθολικού SOP είναι απαραίτητη, διότι διευκολύνει τη σύγκριση δεδομένων εντός μιας χώρας αλλά και μεταξύ χωρών. Είναι πολύ σημαντικό να προσδιορίσετε ξεκάθαρα όλες τις παραμέτρους εκκινητών. Σημειώνουμε ότι αυτό δεν έγινε. Επιπλέον, η τιμή Ct που υποδεικνύει πότε ένα δείγμα πρέπει να θεωρείται θετικό ή αρνητικό δεν προσδιορίζεται. Δεν προσδιορίζεται επίσης όταν ένα δείγμα θεωρείται μολυσμένο με ιούς SARS-CoV. Όπως φαίνεται παραπάνω, η δοκιμή δεν μπορεί να διακρίνει μεταξύ θραυσμάτων ιών και ολόκληρων ιών, επομένως η τιμή Ct που δείχνει τη θετικότητα είναι ζωτικής σημασίας. Αυτή η τιμή Ct θα έπρεπε να είχε καθοριστεί στην Τυποποιημένη Διαδικασία Λειτουργίας (SOP) και να δημοσιευθεί στο διαδίκτυο, έτσι ώστε όλα τα εργαστήρια που διεξάγουν αυτήν τη δοκιμή να έχουν ακριβώς τις ίδιες συνθήκες ορίου. Το γεγονός της έλλειψης ένος τέτοιου SOP υποδηλώνει ελαττωματική επιστήμη (flawed science). Τα εργαστήρια επομένως έχουν αφεθεί ελεύθερα να διενεργούν το τεστ όπως αυτά κρίνουν κατάλληλα, γεγονός που έχει ως αποτέλεσμα μια τεράστια ποσότητα διακύμανσης. Τα εργαστήρια σε όλη την Ευρώπη έχουν αφεθεί με πληθώρα ερωτηματικών.
- Ποιους εκκινητές να παραγγείλουν;
- Ποια νουκλεοτίδια να συμπληρώσουν τα απροσδιόριστα τμήματα;
- Ποια τιμή Tm να επιλέξουν;
- Πόσους κύκλους PCR να εκτελέσουν;
- Για ποια τιμή του Ct είναι θετικό το δείγμα;
- Και πότε είναι αρνητικό;
- Και πόσα γονίδια να δοκιμαστούν;
- Πρέπει να δοκιμαστούν όλα τα γονίδια ή μόνο το γονίδιο E και RpRd όπως φαίνεται στον πίνακα 2 της εργασίας Corman-Drosten;
- Πρέπει επίσης να εξεταστεί το γονίδιο Ν;
- Και ποιος είναι ο αρνητικός έλεγχός τους;
- Ποιος είναι ο θετικός έλεγχός τους;
Το πρωτόκολλο, όπως περιγράφεται, δυστυχώς είναι πολύ ασαφές και λανθασμένο στο σχεδιασμό του με τέτοιο τρόπο που μπορεί να οδηγήσει σε δεκάδες διαφορετικές κατευθύνσεις. Δεν φαίνεται να υπάρχει τυποποίηση ούτε SOP, επομένως δεν είναι σαφές πώς μπορεί να εφαρμοστεί αυτή η δοκιμή.
7. Συνέπειες των σφαλμάτων που περιγράφονται στο σημείο 1-5, ψευδώς θετικά αποτελέσματα.
Το τεστ RT-PCR που περιγράφεται στην εργασία Corman-Drosten περιέχει τόσα πολλά μοριακά σφάλματα βιολογικού σχεδιασμού (βλ. 1-5) που δεν είναι δυνατόν να επιτευχθούν σαφή αποτελέσματα. Είναι αναπόφευκτο αυτό το τεστ να παράγει έναν τεράστιο αριθμό των λεγομένων «ψευδώς θετικών». Ο ορισμός των ψευδών θετικών είναι ένα αρνητικό δείγμα, το οποίο αρχικά βαθμολογείται θετικό, αλλά το οποίο είναι αρνητικό μετά την επανεξέταση με το ίδιο τεστ. Τα ψευδώς θετικά είναι λανθασμένα θετικά αποτελέσματα τεστ, δηλαδή αρνητικά δείγματα που διαγιγνώσκονται ως «θετικά». Και αυτό είναι πράγματι που υπάρχει στην εργασία Corman-Drosten. Στη σελίδα 6 του χειρόγραφου PDF οι συγγραφείς αποδεικνύουν ότι ακόμη και υπό καλά ελεγχόμενες εργαστηριακές συνθήκες, δημιουργείται ένα σημαντικό ποσοστό ψευδών θετικών με αυτό τοτ τεστ:
«Σε τέσσερις μεμονωμένες δοκιμαστικές αντιδράσεις, παρατηρήθηκε ασθενής αρχική αντιδραστικότητα, ωστόσο ήταν αρνητικές κατά την επανεξέταση με την ίδια ανάλυση. Αυτά τα σήματα δεν συσχετίστηκαν με κανένα συγκεκριμένο ιό, και για κάθε ιό με τον οποίο εμφανίστηκε αρχική θετική αντιδραστικότητα, υπήρχαν και άλλα δείγματα που περιείχαν τον ίδιο ιό σε υψηλότερη συγκέντρωση αλλά δεν ήταν θετικά. Δεδομένων των αποτελεσμάτων από την εκτενή τεχνική πιστοποίηση που περιγράφεται παραπάνω, συνήχθη το συμπέρασμα ότι αυτή η αρχική αντιδραστικότητα δεν οφειλόταν στη χημική αστάθεια των ανιχνευτών της PCR σε πραγματικό χρόνο και πιθανότατα στον χειρισμό ζητημάτων που προκλήθηκαν από την ταχεία εισαγωγή νέων διαγνωστικών δοκιμών και ελέγχων κατά τη διάρκεια αυτής της αξιολογικής μελέτης." [1]
Η πρώτη πρόταση αυτού του αποσπάσματος είναι σαφής απόδειξη ότι το τεστ PCR που περιγράφεται στην εργασία Corman-Drosten παράγει ψευδώς θετικά. Ακόμα και υπό τις καλά ελεγχόμενες συνθήκες του υπερσύγχρονου εργαστηρίου Charité, 4 από τα 310 πρωτοβάθμια τεστ είναι ψευδώς θετικά ανά ορισμό. Τέσσερα αρνητικά δείγματα αρχικά δοκιμάστηκαν θετικά και μετά ευρέθησαν αρνητικά κατά την επανεξέταση. Αυτό είναι το κλασικό παράδειγμα ενός ψευδώς θετικού. Σε αυτήν την περίπτωση οι συγγραφείς δεν τα αναγνωρίζουν ως ψευδώς θετικά, κάτι που είναι πνευματικά ανέντιμο.
Μια άλλη αποκαλυπτική παρατήρηση στο παραπάνω απόσπασμα είναι ότι οι συγγραφείς εξηγούν τα ψευδώς θετικά ως «χειρισμός ζητημάτων που προκαλούνται από την ταχεία εισαγωγή νέων διαγνωστικών εξετάσεων». Φανταστείτε τα εργαστήρια που πρέπει να εισαγάγουν το τεστ χωρίς όλες τις απαραίτητες πληροφορίες που συνήθως περιγράφονται σε ένα SOP.
8. Η εργασία Corman-Drosten δεν αξιολογήθηκε/αναθεωρήθηκε από ομοτίμους κριτές
Πριν από την επίσημη δημοσίευση σε ένα επιστημονικό περιοδικό, επιστημονικά και ιατρικά άρθρα πιστοποιούνται παραδοσιακά από την αξιολόγηση από ομοτίμους κριτές (peer review). Σε αυτήν τη διαδικασία, οι συντάκτες του περιοδικού λαμβάνουν συμβουλές από διάφορους εμπειρογνώμονες («διαιτητές») που έχουν αξιολογήσει το έγγραφο και μπορεί να εντοπίσουν αδυναμίες στις παραδοχές, τις μεθόδους και τα συμπεράσματά του. Συνήθως ένα περιοδικό θα δημοσιεύσει ένα άρθρο μόνο όταν οι συντάκτες είναι ικανοποιημένοι ότι οι συγγραφείς έχουν εξετάσει τις ανησυχίες των διαιτητών και ότι τα δεδομένα που παρουσιάζονται υποστηρίζουν τα συμπεράσματα που αναφέρονται στην εργασία. Αυτή η διαδικασία περιγράφεται επίσης και για καλά για την Εurosurveillance [16].
Η εργασία Corman-Drosten υποβλήθηκε στην Eurosurveillance στις 21 Ιανουαρίου 2020 και έγινε δεκτή για δημοσίευση στις 22 Ιανουαρίου 2020. Στις 23 Ιανουαρίου 2020 η εργασία δημοσιεύθηκε στο διαδίκτυο. Στις 13 Ιανουαρίου 2020, η έκδοση 1-0 του πρωτοκόλλου δημοσιεύτηκε στον επίσημο ιστότοπο του ΠΟΥ [17], ενημερώθηκε στις 17 Ιανουαρίου 2020 ως έκδοση εγγράφου 2-1 [18], ακόμη και πριν από την δημοσίευση της εργασίας Corman-Drosten στις 23 Ιανουαρίου στον ιστότοπο της Eurosurveillance.
Κανονικά, η αξιολόγηση από ομοτίμους κριτές είναι μια χρονοβόρα διαδικασία, καθώς τουλάχιστον δύο εμπειρογνώμονες από τον τομέα πρέπει να διαβάσουν και να σχολιάσουν κριτικά την υποβληθείσα εργασία. Κατά τη γνώμη μας, αυτό το έγγραφο δεν αξιολογήθηκε από ομοτίμους. Είκοσι τέσσερις ώρες απλά δεν αρκούν για να πραγματοποιήσουν μια εμπεριστατωμένη αξιολόγηση από ομοτίμους. Το συμπέρασμά μας υποστηρίζεται από το γεγονός ότι εντοπίστηκε τεράστιος αριθμός πολύ σοβαρών ελαττωμάτων σχεδιασμού από εμάς, οι οποίες αποδεικνύουν ότι το τεστ PCR είναι εντελώς ακατάλληλο ως διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2. Οποιοσδήποτε μοριακός βιολόγος εξοικειωμένος με το σχεδιασμό RT-PCR θα είχε παρατηρήσει εύκολα τα σοβαρά σφάλματα που υπάρχουν στην εργασία Corman-Drosten πριν από την πραγματική διαδικασία αναθεώρησης από ομοτίμους κριτές. Στις 26 Οκτωβρίου 2020, ζητήσαμε από την Eurosurveillance να μας στείλει ένα αντίγραφο της έκθεσης αξιολόγησης από ομοτίμους κριτές. Μέχρι σήμερα, δεν έχουμε λάβει αυτήν την έκθεση και σε επιστολή με ημερομηνία 18η Νοεμβρίου 2020, το ECDC ως οικοδεσπότης της Eurosurveillance αρνήθηκε να παράσχει πρόσβαση χωρίς όμως να παρέχει σημαντικούς επιστημονικούς λόγους για την απόφασή του αυτή. Αντιθέτως, γράφουν ότι «η δημοσιοποίηση θα υπονόμευε τον σκοπό των επιστημονικών ερευνών». [24].
9. Συγγραφείς ως συντάκτες
Ένα τελευταίο σημείο συνιστά και ένα από τους κύριους προβληματισμούς. Αποδεικνύεται ότι δύο συγγραφείς της εργασίας Corman-Drosten, ο Christian Drosten και η Chantal Reusken, είναι επίσης μέλη του συντακτικού συμβουλίου αυτού του περιοδικού [19]. Ως εκ τούτου, υπάρχει μια σοβαρή σύγκρουση συμφερόντων που ενισχύει τις υποψίες ότι η εργασία δεν αξιολογήθηκε από ομοτίμους κριτές. Φαίνεται ότι η ταχεία δημοσίευση ήταν δυνατή απλώς και μόνο επειδή οι συγγραφείς ήταν επίσης μέλη του συντακτικού συμβουλίου της Eurosurveillance. Αυτή η πρακτική υπονομεύει την επιστημονική ακεραιότητα.
ΠΕΡΙΛΗΨΗ ΚΑΤΑΛΟΓΟΥ ΣΦΑΛΜΑΤΩΝ ΠΟΥ ΕΝΤΟΠΙΣΘΗΚΑΝ ΣΤΗΝ ΕΡΓΑΣΙΑ
Η εργασία Corman-Drosten περιέχει τα ακόλουθα συγκεκριμένα σφάλματα:
- Δεν υπάρχει συγκεκριμένος λόγος για τη χρήση αυτών των εξαιρετικά υψηλών συγκεντρώσεων των εκκινητών σε αυτό το πρωτόκολλο. Οι περιγραφόμενες συγκεντρώσεις οδηγούν σε αυξημένους μη-ειδικούς υβριδισμούς και ενισχύσεις προϊόντων PCR, καθιστώντας το τεστ ακατάλληλο ως ειδικό διαγνωστικό εργαλείο για την ταυτοποίηση του ιού SARS-CoV-2.
- Έξι απροσδιόριστες ασταθείς θέσεις εισαγάγουν μια τεράστια μεταβλητότητα στις πραγματικές εργαστηριακές εφαρμογές αυτού του τεστ, η συγκεχυμένη μη ειδική περιγραφή στην εργασία Corman-Drosten δεν είναι κατάλληλη ως Τυποποιημένη Διαδικασία Λειτουργίας-ΤΔΛ, καθιστώντας το τεστ ακατάλληλο ως ειδικό διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2.
- Το τεστ δεν δύναται να διακρίνει μεταξύ ολόκληρου του ιού και των ιϊκών θραυσμάτων. Επομένως, το τεστ δεν μπορεί να χρησιμοποιηθεί ως διαγνωστικό για άθικτους (μολυσματικούς) ιούς, το ελάττωμα αυτό καθιστά το τεστ ακατάλληλο ως ειδικό διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2 και να εξάγει συμπεράσματα σχετικά με την παρουσία λοίμωξης.
- Η διαφορά των 10° C σε σχέση με τη θερμοκρασία υβριδισμού Tm για το ζεύγος εκκινητών 1 (RdRp_SARSr_F και RdRp_SARSr_R) καθιστά επίσης τη δοκιμή ακατάλληλη ως ειδικό διαγνωστικό εργαλείο για την αναγνώριση του ιού SARS-CoV-2.
- Ένα σοβαρό σφάλμα είναι η παράλειψη τιμής για την Ct με την οποία ένα δείγμα θεωρείται θετικό και αρνητικό. Αυτή η τιμή Ct δεν αναφέρεται επίσης σε μεταγενέστερες εκδόσεις γεγονός που καθιστά τη δοκιμή ακατάλληλη ως ένα ειδικό διαγνωστικό εργαλείο για την αναγνώριση του ιού SARS-CoV-2.
- Τα προϊόντα PCR δεν έχουν επικυρωθεί σε μοριακό επίπεδο. Αυτό το γεγονός καθιστά το πρωτόκολλο άχρηστο ως ειδικό διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2.
- Η δοκιμή PCR δεν περιέχει ούτε έναν μοναδικό θετικό έλεγχο για την αξιολόγηση της ειδικότητας του για το SARS-CoV-2 ούτε έναν αρνητικό έλεγχο για τον αποκλεισμό της παρουσίας άλλων κορονοϊών, καθιστώντας το τεστ ακατάλληλο ως ειδικό διαγνωστικό εργαλείο για την ταυτοποίηση του SARS-CoV-2 ιός.
- Ο σχεδιασμός του τεστ στην εργασία Corman-Drosten είναι τόσο ασαφής και ελαττωματικός που μπορεί κανείς να πάει σε δεκάδες διαφορετικές κατευθύνσεις. τίποτα δεν είναι τυποποιημένο και απουσιάζει μια Τυποποιημένη Διαδικασία Λειτουργίας-ΤΔΛ (SOP). Αυτό αμφισβητεί ιδιαίτερα την επιστημονική εγκυρότητα του τεστ και το καθιστά ακατάλληλο ως ειδικό διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2.
- Πιθανότατα, η εργασία Corman-Drosten δεν αξιολογήθηκε από ομοτίμους κριτές (peer review), καθιστώντας το τεστ ακατάλληλο ως ειδικό διαγνωστικό εργαλείο για τον εντοπισμό του ιού SARS-CoV-2.
- Βρίσκουμε σοβαρές συγκρούσεις συμφερόντων για τουλάχιστον τέσσερις συγγραφείς, εκτός από το γεγονός ότι δύο από τους συγγραφείς της εργασίας Corman-Drosten (ο Christian Drosten και η Chantal Reusken) είναι μέλη του συντακτικού συμβουλίου της Eurosurveillance. Ακόμα μια σύγκρουση συμφερόντων προστέθηκε στις 29 Ιουλίου 2020 (ο Olfert Landt είναι διευθύνων σύμβουλος της TIB-Molbiol · ο Marco Kaiser είναι ανώτερος ερευνητής στο GenExpress και υπηρετεί ως επιστημονικός σύμβουλος για την TIB-Molbiol), που δεν δηλώθηκε στην αρχική έκδοση (και εξακολουθεί να λείπει στην έκδοση της PubMed) · Η TIB-Molbiol είναι η εταιρεία που ήταν «η πρώτη» που παρήγαγε το κιτ του τεστ PCR (Light Mix) με βάση το πρωτόκολλο που δημοσιεύθηκε στην εργασία Corman-Drosten και σύμφωνα με τις δικές τους λέξεις, διένειμαν αυτά τα κιτ των τεστ PCR πριν από την υποβολή της δημοσίευσης [20] περαιτέρω, ο Victor Corman & ο Christian Drosten απέτυχαν να δηλώσουν τη δεύτερη σχέση τους: την επιχείρηση- εργαστήριο διενέργειας τεστ «Labor Berlin». Και οι δύο είναι υπεύθυνοι για τη διάγνωση ιών στην επιχείρηση αυτή [21] και η εταιρεία δραστηριοποιείται στον τομέα των δοκιμών PCR σε πραγματικό χρόνο.
Υπό το φως της επανεξέτασης του πρωτοκόλλου δοκιμών για τον προσδιορισμό του SARS-CoV-2 που περιγράφεται στην εργασία Corman-Drosten, έχουμε εντοπίσει ανησυχητικά σφάλματα και εγγενείς παραπλανητικές ενδείξεις που καθιστούν το τεστ SARS-CoV-2 PCR άχρηστο.
ΣΥΜΠΕΡΑΣΜΑ
Η απόφαση σχετικά με το ποια πρωτόκολλα τεστ δημοσιεύονται και διατίθενται ευρέως βρίσκεται ακριβώς στα χέρια της Eurosurveillance. Μια απόφαση για την αναγνώριση των σφαλμάτων που παρουσιάζει η εργασία Corman-Drosten έχει το πλεονέκτημα να ελαχιστοποιήσει σημαντικά το ανθρώπινο κόστος και τα βάσανα.
Δεν είναι προς το συμφέρον της Eurosurveillance να αποσύρει αυτό το έγγραφο;
Το συμπέρασμά μας είναι σαφές. Ενόψει όλων των τεράστιων ατελειών και σφαλμάτων του σχεδιασμού του πρωτοκόλλου PCR που περιγράφονται εδώ, καταλήγουμε στο συμπέρασμα: Δεν απομένουν πολλές επιλογές στο πλαίσιο της επιστημονικής ακεραιότητας και ευθύνης.
ΒΙΒΛΙΟΓΡΑΦΙΚΕΣ ΑΝΑΦΟΡΕΣ
[1] Corman Victor M, Landt Olfert, Kaiser Marco, Molenkamp Richard, Meijer Adam, Chu Daniel KW, Bleicker Tobias, Brünink Sebastian, Schneider Julia, Schmidt Marie Luisa, Mulders Daphne GJC, Haagmans Bart L, van der Veer Bas, van den Brink Sharon, Wijsman Lisa, Goderski Gabriel, Romette Jean-Louis, Ellis Joanna, Zambon Maria, Peiris Malik, Goossens Herman, Reusken Chantal, Koopmans Marion PG, Drosten Christian. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020;25(3):pii=2000045. https://doi.org/10.2807/1560-7917.ES.2020.25.3.2000045
[2] Email communication between Dr. Peter Borger & Dr. Adam Meijer: Supplementary Material
[3] Jafaar et al., Correlation Between 3790 Quantitative Polymerase Chain Reaction–Positives Samples and Positive Cell Cultures, Including 1941 Severe Acute Respiratory Syndrome Coronavirus 2 Isolates. https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa1491/5912603
[4] BBC, January 21st 2020: https://www.bbc.com/news/world-asia-china-51185836;
Archive: https://archive.is/0qRmZ
[5] Google Analytics – COVID19-deaths worldwide: https://bit.ly/3fndemJ
Archive: https://archive.is/PpqEE
[6] Laboratory testing for COVID-19 Emergency Response Technical Centre, NIVD under
China CDC March 15th, 2020: http://www.chinacdc.cn/en/COVID19/202003/P020200323390321297894.pdf
[7] Real-Time PCR Handbook Life Technologies: https://www.thermofisher.com/content/dam/LifeTech/global/Forms/PDF/real-time-pcr-
handbook.pdf
Nolan T, Huggett J, Sanchez E.Good practice guide for the application of quantitative PCR (qPCR) First Edition 2013
[8] Trestan Pillonel et al, Letter to the editor: SARS-CoV-2 detection by real-time RT-PCR: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7268274/
[9] Kurkela, Satu, and David WG Brown. “Molecular-diagnostic techniques.” Medicine 38.10
(2009): 535-540.
[10] Wolfel et al., Virological assessment of hospitalized patients with COVID-2019
https://www.nature.com/articles/s41586-020-2196-x
[11] Thermofischer Primer Dimer Web Tool: https://www.thermofisher.com/us/en/home/brands/thermo-scientific/molecular-biology/molecular-biology-learning-center/molecular-biology-resource-library/thermo-scientific-web-tools/multiple-primer-analyzer.html
Supplementary Material
[12] Primer-BLAST, NCBI – National Center for Biotechnology Information: https://www.ncbi.nlm.nih.gov/tools/primer-blast/
[13] Marra MA, Steven JMJ, Caroline RA, Robert AH, Angela BW et al. (2003) Science. The
Genome sequence of the SARS-associated coronavirus. Science 300(5624): 1399-1404.
[14] Severe acute respiratory syndrome coronavirus 2 isolate Wuhan-Hu-1, complete
genome: https://www.ncbi.nlm.nih.gov/nuccore/MN908947
[15] Borger P. A SARS-like Coronavirus was expected but nothing was done to be prepared. Am J Biomed Sci Res 2020. https://biomedgrid.com/pdf/AJBSR.MS.ID.001312.pdf
https://www.researchgate.net/publication/341120750_A_SARS-
like_Coronavirus_was_Expected_but_nothing_was_done_to_be_Prepared;
Archive: https://archive.is/i76Hu
[16] Eurosurveillance paper evaluation / review process: https://www.eurosurveillance.org/evaluation
[17] Official recommendation of the Corman-Drosten protocol & manuscript by the WHO,published on January 13th 2020 as version 1.0 of the document:
https://www.who.int/docs/default-source/coronaviruse/wuhan-virus-assay-
v1991527e5122341d99287a1b17c111902.pdf; archive: https://bit.ly/3m3jXVH
[18] Official WHO-recommendation for the Corman / Drosten RT-qPCR-protocol, which
directly derives from the Eurosurveillance-publication, document-version 2-1, published on
17th January 2020: https://www.who.int/docs/default-source/coronaviruse/protocol-v2-
1.pdf?sfvrsn=a9ef618c_2
[19] Eurosurveillance Editorial Board, 2020: https://www.eurosurveillance.org/upload/site-
assets/imgs/2020-09-Editorial%20Board%20PDF.pdf;
Archive: https://bit.ly/2TqXBjX
[20] Instructions For Use LightMix SarbecoV E-gene plus EAV Control, TIB-Molbiol & Roche
Molecular Solutions, January 11th 2020: https://www.roche-as.es/lm_pdf/MDx_40-0776_96_Sarbeco-E-
gene_V200204_09164154001 (1).pdf
Archive, timestamp – January 11th 2020: https://archive.is/Vulo5;
Archive: https://bit.ly/3fm9bXH
[21] Christian Drosten & Victor Corman, responsible for viral diagnostics at Labor Berlin:
https://www.laborberlin.com/fachbereiche/virologie/
Archive: https://archive.is/CDEUG
[22] Tom Jefferson, Elizabeth Spencer, Jon Brassey, Carl Heneghan Viral cultures for COVID-
19 infectivity assessment. Systematic review. Systematic review doi:
https://doi.org/10.1101/2020.08.04.20167932 https://www.medrxiv.org/content/10.1101/2020.08.04.20167932v4
[23] Kim et al.,The Architecture of SARS-CoV-2 Transcriptome:
https://www.sciencedirect.com/science/article/pii/S0092867420304062
[24] ECDC reply to Dr. Peter Borger, 18th November 2020:
Supplementary Material
[25] Prof. Dr. Ulrike Kämmerer & team, survey & Primer-BLAST table:
Supplementary Material
Επιπλέον βιβλιογραφία:
Description RT-PCR RKI Germany, on page 10 of this link:
https://www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBE
DownloadsJ/JoHM_S5_2020_Studienprotokoll_CORONA_MONITORING_lokal.pdf?__blob=p
ublicationFile
Συνεργασίες συγγραφέα :
1) Dr. Pieter Borger (MSc, PhD), Molecular Genetics, W+W Research Associate, Lörrach, Germany
2) Rajesh Kumar Malhotra (Artist Alias: Bobby Rajesh Malhotra), Former 3D Artist / Scientific Visualizations at CeMM – Center for Molecular Medicine of the Austrian Academy of Sciences (2019-2020), University for Applied Arts – Department for Digital Arts Vienna, Austria
3) Dr. Michael Yeadon BSs(Hons) Biochem Tox U Surrey, PhD Pharmacology U Surrey. Managing Director, Yeadon Consulting Ltd, former Pfizer Chief Scientist, United Kingdom
4) Dr. Clare Craig MA, (Cantab) BM, BCh (Oxon), FRCPath, United Kingdom
5) Kevin McKernan, BS Emory University, Chief Scientific Officer, founder Medical Genomics, engineered the sequencing pipeline at WIBR/MIT for the Human Genome Project, Invented and developed the SOLiD sequencer, awarded patents related to PCR, DNA Isolation and Sequencing, USA
6) Prof. Dr. Klaus Steger, Department of Urology, Pediatric Urology and Andrology, Molecular Andrology, Biomedical Research Center of the Justus Liebig University, Giessen, Germany
7) Dr. Paul McSheehy (BSc, PhD), Biochemist & Industry Pharmacologist, Loerrach, Germany
8) Dr. Lidiya Angelova, MSc in Biology, PhD in Microbiology, Former researcher at the National Institute of Allergy and Infectious Diseases (NIAID), Maryland, USA
9) Dr. Fabio Franchi, Former Dirigente Medico (M.D) in an Infectious Disease Ward, specialized in “Infectious Diseases” and “Hygiene and Preventive Medicine”, Società Scientifica per il Principio di Precauzione (SSPP), Italy
10) Dr. med. Thomas Binder, Internist and Cardiologist (FMH), Switzerland
11) Prof. Dr. med. Henrik Ullrich, specialist Diagnostic Radiology, Chief Medical Doctor at the Center for Radiology of Collm Oschatz-Hospital, Germany
12) Prof. Dr. Makoto Ohashi, Professor emeritus, PhD in Microbiology and Immunology, Tokushima University, Japan
13) Dr. Stefano Scoglio, B.Sc. Ph.D., Microbiologist, Nutritionist, Italy
14) Dr. Marjolein Doesburg-van Kleffens (MSc, PhD), specialist in Laboratory Medicine (clinical chemistry), Maasziekenhuis Pantein, Beugen, The Netherlands
15) Dr. Dorothea Gilbert (MSc, PhD), PhD Environmental Chemistry and Toxicology. DGI Consulting Services, Oslo, Norway
16) Dr. Rainer J. Klement, PhD. Department of Radiation Oncology, Leopoldina Hospital Schweinfurt, Germany
17) Dr. Ruth Schruefer, PhD, human genetics/ immunology, Munich, Germany,
18) Dra. Berber W. Pieksma, General Practitioner, The Netherlands
19) Dr. med. Jan Bonte (GJ), Consultant Neurologist, The Netherlands
20) Dr. Bruno H. Dalle Carbonare (Molecular biologist), IP specialist, BDC Basel, Switzerland
21) Dr. Kevin P. Corbett, MSc Nursing (Kings College London) PhD (London South Bank) Social Sciences (Science & Technology Studies) London, England, United Kingdom
22) Prof. Dr. Ulrike Kämmerer, specialist in Virology / Immunology / Human Biology / Cell Biology, University Hospital Würzburg, Germany
Συνεισφορές συγγραφέα:
PB: Planned and conducted the analyses and research, conceptualising the manuscript.
BRM: Planned and conducted the research, conceptualising the figures and manuscript.
MY: Proofreading the analyses and research.
KMcK: Conducted the analyses and research, conceptualized the manuscript.
KS: Conducted the analyses and research.
PMcS: Proofreading the analyses and research.
LA: Proofreading the analyses and research.
FF: Proofreading the analyses and research.
TB: Proofreading the analyses and research.
HU: Proofreading the analyses and research.
MO: Proofreading the analyses and research.
SS: Proofreading the analyses and research.
MDvK: Proofreading the analyses and research.
DG: Proofreading the analyses and research.
RJK: Proofreading the analyses and research.
RS: Proofreading the analyses and research, and the manuscript.
BWK: Proofreading the analyses and research.
RvV: Proofreading the analyses and research.
JB: Proofreading the analyses and research.
KC: Proofreading the analyses and research.
UK: Planned and conducted the analyses and research, conceptualising the manuscript.
Πρόσθετοι διορθωτές τυπογραφικού δοκιμίου:
Saji N Hameed, Environmental Informatics, University of Aizu, Tsuruga, Ikki-machi, Aizuwakamatsu-shi, Fukushima, Japan
Howard R. Steen, MA Chem. Eng. Cantab, Former Research Manager, Germany
Προσθήκη
Ενημέρωση 2.12.2020:
Author Contribution Dr. Michael Yeadon changed to: Proofreading the analyses and research.
Author Affiliation Kevin Mckernan changed to: Medicinal Genomics.